
知识中心

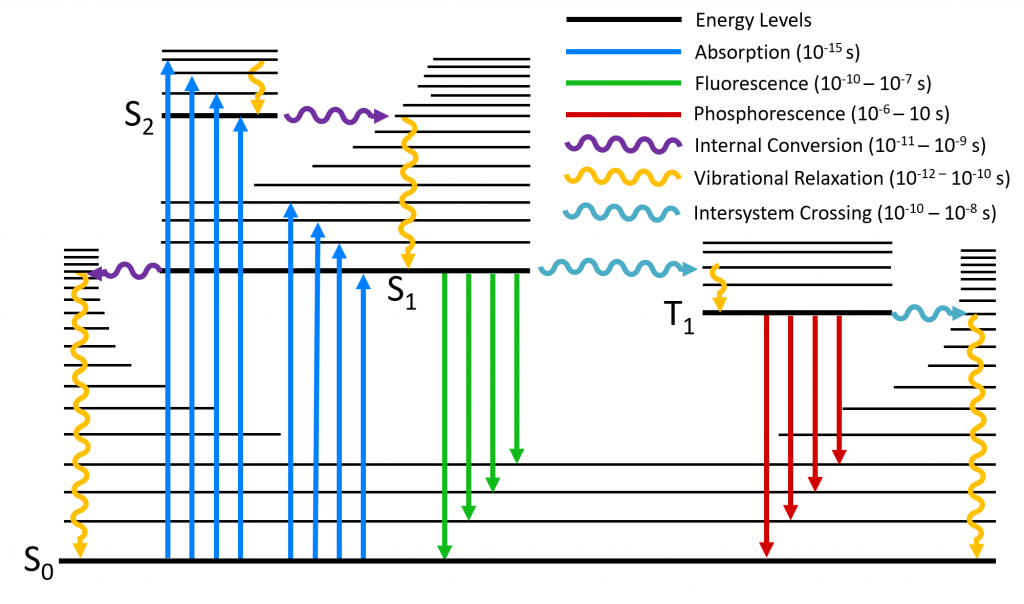
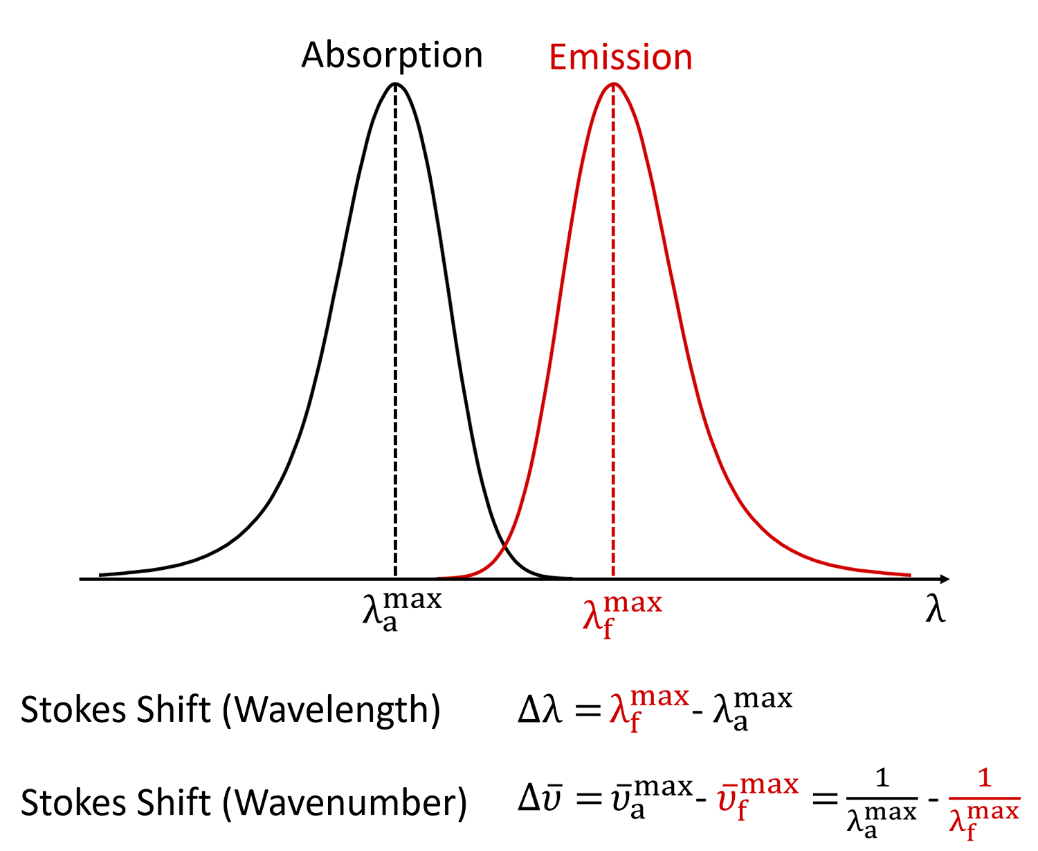
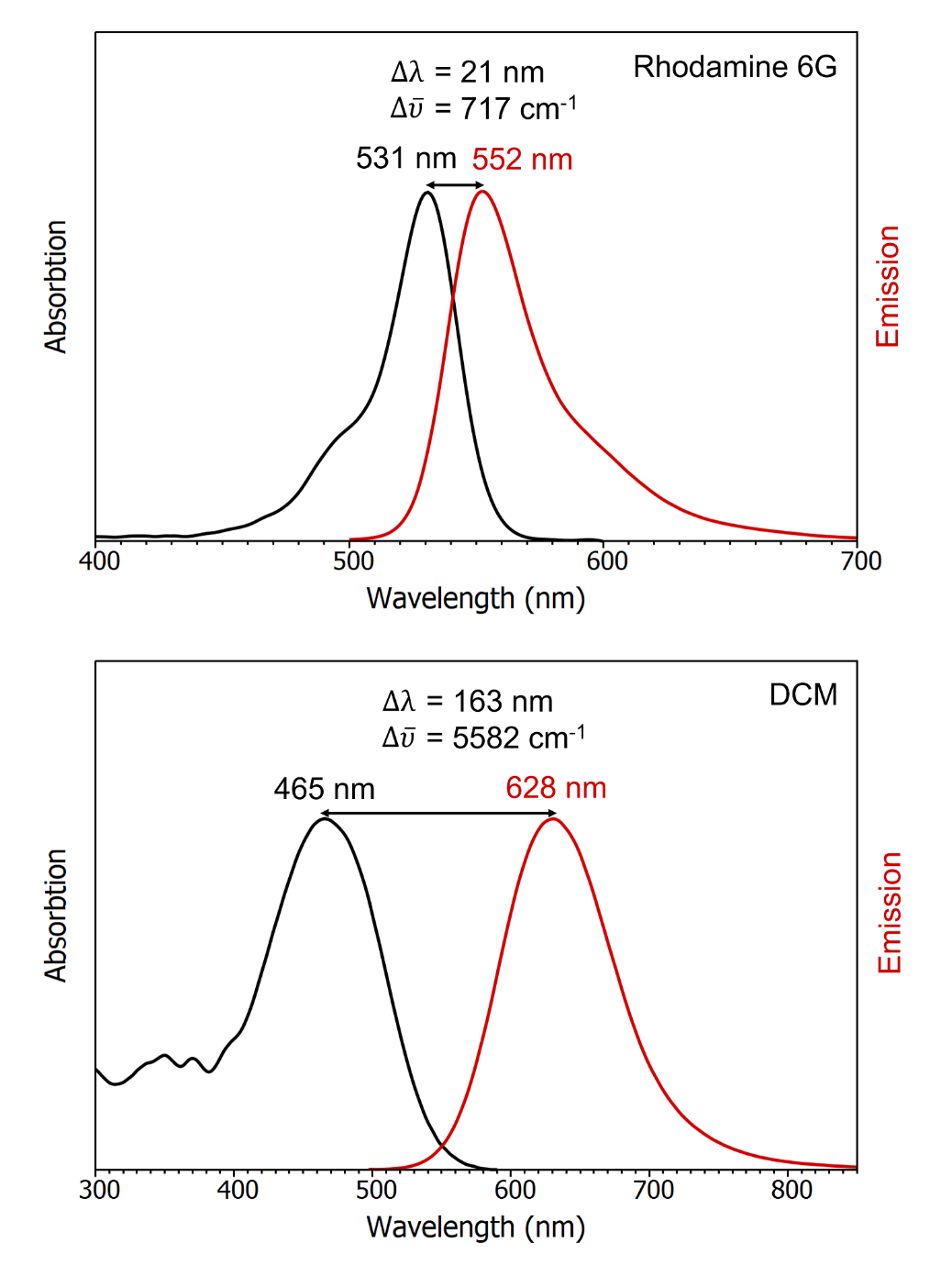
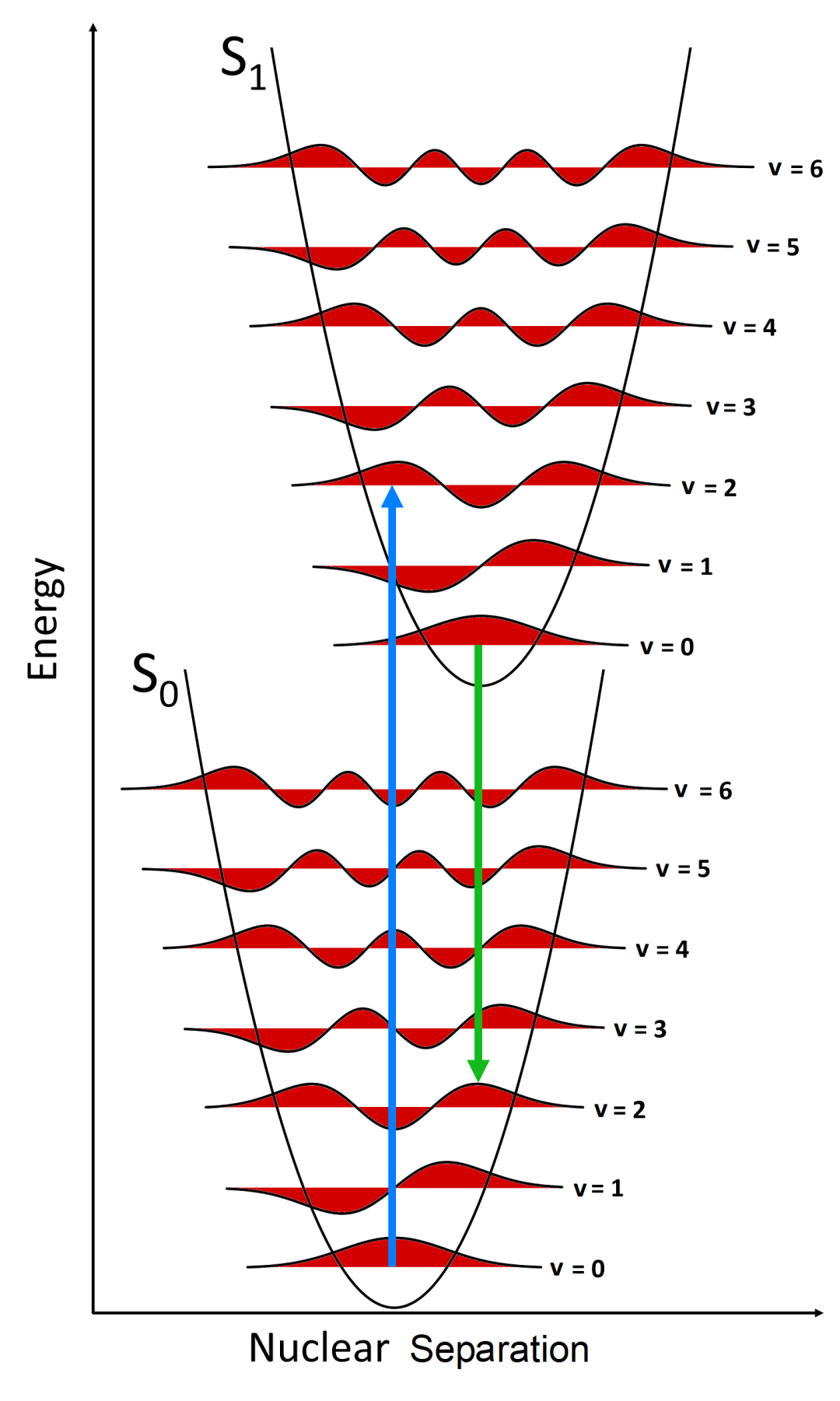
Jablonski能级图清楚地可视化了分子在受到光激发后可能产生的跃迁情况。 吸收能量(Absorption):如图中蓝色箭头所示,分子通过吸收光子从基态跃迁到更高能级,这是雅布隆斯基能级图中最快的跃迁过程,发生在10⁻¹⁵秒量级的时间尺度上。室温条件下,根据玻尔兹曼分布,体系中大多数分子都处于基态的最低振动能级,因此图中显示的吸收过程均起始于该能级。分子吸收光子后,会从基态S₀跃迁至单重激发态(S₁、S₂等)的某个振动能级;此外由于角动量守恒的限制,分子不能直接被激发至三重激发态(T₁、T₂等)。 振动弛豫(Vibrational Relaxation):分子吸收能量跃迁至激发态后,处于不稳定状态,最终会通过能级弛豫过程返回到基态。首个能量耗散途径是振动弛豫(橙色箭头):过剩的振动能量通过分子内或分子间振动传递,直至达到电子态的最低振动能级。振动弛豫过程极其迅速,发生在10⁻¹² - 10⁻¹⁰ s的时间尺度上,其速率快于其他所有跃迁过程。 内转换(Internal Conversion):处于较高单重激发态的分子也可能通过内转换过程(紫色箭头)向较低的单重激发态跃迁。内转换过程发生后会立即伴随振动弛豫,使分子跃迁至该电子态的最低振动能级。内转换的速率与两电子态之间的能隙成反比;对于能级间隔较小的高能级单重激发态(如S₃→S₂、S₂→S₁等),其内转换过程极其迅速,发生在10⁻¹¹ - 10⁻⁹ s内。而S₁与S₀态之间的能隙要大得多,这两个电子态之间的内转换过程耗时更长,并且会与荧光、系间窜越等其他跃迁过程形成竞争。 荧光(Fluorescence):荧光产生于S₁→S₀的跃迁过程中(绿色箭头,10⁻¹⁰ - 10⁻⁷ s),由上述的振动弛豫和内转换的快速进行,且Kasha规则[1]指出对于多重态的分子,光子仅能由最低激发态发射;因此除少数情况外,荧光发射均产生于分子从第一电子激发态S₁的最低振动能级跃迁回单重态基态S₀的这一过程。此现象也导致了斯托克斯位移(Stokes-Shift)的产生,即荧光发射波长大于激发波长。 系间窜越(Intersystem Crossing):作为荧光和内转换之外的一种弛豫途径,允许分子从第一激发单重态S₁跃迁至第一激发三重态T₁。因自旋角动量守恒,该跃迁本属禁阻过程;然而,借助自旋角动量与轨道角动量间的耦合效应(即自旋-轨道耦合),该过程可转变为弱允许跃迁。系间窜越与S₁态内转换和荧光过程存在竞争关系,所以对于大多数纯有机分子而言,此过程速率过慢而不具显著意义。提升系间窜越速率的一种有效策略是在分子中引入重原子,通过增强自旋-轨道耦合强度来实现。完成系间窜越后,分子会立即通过振动弛豫降至T₁态的基振动能级。 磷光(Phosphorescence):磷光来自于T₁→S₀跃迁发射光子的过程。与系间窜越相似,磷光在理论上属于禁阻跃迁,但通过自旋-轨道耦合作用可弱允许发生。这种跃迁的禁阻特性导致磷光衰退速率常数极低,因此其发生的时间尺度远大于荧光,典型的磷光寿命范围在10⁻⁶ - 10 s。 延迟荧光(Delayed Fluorescence):第三种辐射跃迁类型被称为延迟荧光,延迟发光的产生源于处于T₁态的分子先跃迁至S₁态,继而通过辐射跃迁返回S₀态;这导致此过程发射的光波长与标准荧光完全相同,但发生在更长的时间尺度上。 图1 Jablonski能级图 激发态分子在弛豫能量过程中,除了荧光发射,还会以非辐射弛豫消耗一部分能量。因此发射能量总是小于激发能量,发射波长大于激发波长,这种现象被称为斯托克斯位移。 在光谱中表现为第一吸收带峰值最大位置与发射峰值最大位置之间的差值,可以用波长(nm)或者波数(cm-1)表示。图2中的公式给出了斯托克斯位移一般算法,在使用波数计算时,应注意需要将光谱转换为波数尺度,并从波数光谱中定位最大值进行计算[3]。 图2 荧光光谱的Stokes-Shift[2] 另外斯托克斯位移的大小取决于特定的荧光基团和溶剂环境,通常在极性溶剂中可以观察到更更大的斯托克斯位移。图3是两个荧光基团在不同溶剂下的发射和吸收光谱,表现出了不同的斯托克斯位移。 图3 FS5荧光光谱仪测试的在乙醇中的罗丹明6G(C28H31ClN2O3)和在低浓度H2SO4中的4-(二氰甲基亚甲基)-2-甲基-6-(4-二甲基氨基苯乙烯基)-4H-吡喃(DCM)的吸收和发射光谱 斯托克斯位移通常产生于分子受激发跃迁至S₁的更高振动能级,然后伴随非常迅速的振动弛豫跃迁到S₁的最低振动能级,再跃迁回基态的这一过程中,与前述的荧光过程一致:损失部分能量使得跃迁所产生的激发光波长小于发射光波长。如果在初始情况,分子只跃迁至S₁的最低振动能级,再跃迁回基态S₀;这一过程不伴随非辐射弛豫,由于激发跃迁和辐射跃迁等能,所以使得斯托克斯位移不存在,但概率极小。 分子跃迁的情况由初始能级和最高能级之间的粒子数差异以及这些能级之间的跃迁概率所决定,跃迁概率可由弗兰克-康顿原理[4](Franck-Condon principle)计算。该原理指出,在分子电子跃迁过程中,当两个振动能级(分别属于不同的电子能级)的波函数有效重叠程度最大时,这两个振动能级之间的跃迁发生的概率最大。在室温条件下,由玻尔兹曼分布可以得到S₀的v=0有更多的轨道布居数,所以大部分的吸收跃迁起始于此(图4蓝色箭头);最强的吸收跃迁是S₁的振动能级与S₀的v=0有最大的波函数重叠时所发生的跃迁。在S₀的v=0处的波函数峰值最大的地方意味着电子出现的概率最大,垂直向上经过振动能级的波函数,当两个波函数的叠加最大时,跃迁的概率也就最大。沿S₀的v=0垂直向上,经过S₁的v=0时,由于两个波函数的中心间距很大,所形成的重叠程度很小,所以这意味着S₁的v=0到S₀的v=0的跃迁概率极小;类似地,当经过S₁的v=2时,两个波函数叠加程度很大,此处跃迁定义了吸收光谱的最大波长。 由前述:分子在S₁激发态的高振动能级首先发生振动弛豫跃迁到最低振动能级S₁的v=0,再由S₁的v=0向S₀处跃迁发光;而S₁的v=0处的波函数与S₀的v=2处的波函数重叠程度最大,这也定义了荧光发射的最大波长。所以荧光发射光谱的最高峰位置总是大于激发光谱的最高峰位置。 图4 Franck-Condon principle图 此节内容参考了Edinburgh Instruments knowledgebase 以及部分文献如下: Web: https://www.edinst.com/knowledgebase/ References: [1] IUPAC, Compendium of Chemical Terminology, 2nd ed. (the “Gold Book”); Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications (1997). [2] Valeur, and M. N. Berberan-Santos, Molecular Fluorescence: Principles and Applications, 2nd Ed. Wiley-VCH (2012). [3] Lakowicz, Principles of Fluorescence Spectroscopy,3rd ed. Springer (2006). [4] Franck, J. (1926). "Elementary processes of photochemical reactions". Transactions of the Faraday Society. 21: 536–542. doi:10.1039/tf9262100536.Jablonski能级图
斯托克斯位移(Stokes-Shift)
参考来源






